1 产品基本信息
产品名称(中文):FT™ 647A-Annexin V/PI 细胞凋亡试剂盒
产品名称(英文):FT™ 647A-Annexin V/PI Apoptosis Kits
产品编号:MX1532
产品组分
组分 | MX1532S (10 T) | MX1532M (50 T) | MX1532L (100 T) |
A. 1 ×Annexin V 结合缓冲液 | 10 mL | 50 mL | 2 ×50 mL |
B. FT™ 647A-Annexin V | 50 μL | 250 μL | 500 μL |
C. PI | 100 μL | 500 μL | 1 mL |
注:B组分请勿冻存
2 规格或纯度
10 T ,50 T ,100 T
3 产品介绍
产品简介:
FT™ 647A-Annexin V和PI凋亡试剂盒提供了一种通过标记早期凋亡细胞(远红)和坏死或晚期凋亡的细胞(红色)快速简便地检测细胞凋亡水平的方法。Annexin V(膜联蛋白-V)是一种分子量为35~36 KD的Ca2+依赖性磷脂结合蛋白,可与磷脂酰丝氨酸(PS)选择性结合。磷脂酰丝氨酸(PS)主要分布在细胞膜内侧,即与细胞质相邻的一侧。在细胞发生凋亡的早期,不同类型的细胞都会把磷脂酰丝氨酸外翻到细胞表面,暴露在细胞外环境中,此时,使用远红外探针FT™ 647A-Annexin V与外翻的磷脂酰丝氨酸(PS)结合,就可用流式细胞仪或荧光显微镜直接检测到磷脂酰丝氨酸的外翻这一细胞凋亡的重要特征。碘化丙啶(Propidium Iodide, PI)是一种DNA结合染料,它可以染色坏死细胞或凋亡晚期丧失细胞膜完整性的细胞的细胞核。PI可以由488、532或546 nm的激光激发,呈现红色荧光。检测原理见图 1。

图 1 Annexin V细胞凋亡试剂盒检测原理图
产品特点:
l选择性多:颜色选择多,选择范围广;
l稳定性好:荧光亮度强且不易淬灭;
l分群效果好:特异性强、细胞分群明显。
适用范围:
细胞凋亡检测
产品参数
FT™ 647A-Annexin V:Ex/Em:650/665 nm
PI:Ex/Em :535/617 nm (With DNA)
4 储存与运输
储存条件:4 ℃ 避光保存
运输条件:冰袋运输
5 使用方法(仅供参考)
一、自备材料
1. 耗材:离心管
2. 试剂:(1)细胞样本 (2)PBS (3)培养基
3. 仪器:流式细胞仪
二、操作步骤
1. 实验组别设计
无自发荧光样本
组别 | Annexin V | 核染料 | 样本类型 |
空白对照组 | - | - | 不做任何处理的细胞 |
阴性对照组 | + | + | 不做任何处理的细胞 |
单阳对照组1 | + | - | 有明显的凋亡的细胞 |
单阳对照组2 | - | + | 有明显的凋亡的细胞 |
实验组 | + | + | 实验组细胞 |
自发荧光样本
组别 | Annexin V | 核染料 | 样本类型 |
空白对照组 | - | - | 不做任何处理无自发荧光的细胞 |
阴性对照组 | + | + | 不做任何处理有自发荧光的细胞 |
单阳对照组1 | + | - | 无自发荧光有明显的凋亡的细胞 |
单阳对照组2 | - | + | 无自发荧光有明显的凋亡的细胞 |
单阳对照组3 | - | - | 带自发荧光的细胞 |
实验组 | + | + | 实验组细胞 |
空白对照:调节阈值和仪器电压。
阴性对照:排除实验操作对实验结果的影响,扣除荧光背景,同时还可以作为实验组划门的依据。
单阳对照:调节补偿,同时也可以辅助调节该通道的电压,防止信号超出仪器接收范围。
实验组:用空白管和单染管调节好电压补偿后,获得所需要的流式数据。
2. 收集细胞
(1)对于悬浮细胞
1)在进行完细胞凋亡刺激后,1000 rpm离心5 min,弃上清,收集细胞,用PBS轻轻重悬细胞并计数。
注:PBS重悬不能省略,PBS重悬的过程同时也起到了洗涤细胞的作用,可以保证后续Annexin V的结合。
2)取5×105 ~1×106个重悬的细胞,1000 rpm离心5 min,弃上清,加入100 µL 1×Annexin V结合缓冲液轻轻重悬细胞。
3)加入5 µL FT™ 647A-Annexin V,轻轻混匀。
4)加入5 µL PI染色液,轻轻混匀。
5)室温(20~25 ℃)避光孵育10~15min。可以使用铝箔进行避光。孵育过程中可以重悬细胞2~3次以改善染色效果。
(2)对于贴壁细胞
1)把细胞培养液吸出至一合适离心管内,PBS洗涤贴壁细胞一次,加入适量胰酶细胞消化液(不含EDTA)消化细胞。室温孵育至轻轻吹打可以使贴壁细胞吹打下来时,即可停止消化。这一步需避免胰酶的过度消化。
注:对于贴壁细胞,胰酶消化步骤很关键。胰酶消化时间如果过短,细胞需要用力吹打才能脱落,容易造成细胞膜的损伤,从而导致细胞坏死的假阳性;消化时间如果过长,同样易造成细胞膜损伤而出现细胞坏死的假阳性,甚至会影响细胞膜上磷脂酰丝氨酸与Annexin V的结合从而干扰对于细胞凋亡的检测。
2)加入上步中收集的细胞培养液,把细胞轻轻吹打下来,转移到离心管内,1000 rpm离心5 min,弃上清,收集细胞,用PBS轻轻重悬细胞并计数。
注:加入上步中的细胞培养液非常重要,一方面可以收集已经悬浮的发生凋亡或坏死的细胞,另一方面细胞培养液中的血清可以有效抑制或中和残留的胰酶。残留的胰酶会消化并降解后续加入的Annexin V,导致染色失败。
3)取5×105~1×106个重悬的细胞,1000 rpm离心5 min,弃上清,加入100 µL 1 ×Annexin V结合缓冲液轻轻重悬细胞。
4)加入5 µL FT™ 647A-Annexin V,轻轻混匀。
5)加入5 µL PI染色液,轻轻混匀。
6)室温(20~25 ℃)避光孵育10~15 min。可以使用铝箔进行避光。孵育过程中可以重悬细胞2~3次以改善染色效果。
3. 结果分析
(1)流式细胞仪检测
1)孵育完成后,可直接加入400 μL 1×Annexin V结合缓冲液重悬细胞,立即上机检测,FT™ 647A-Annexin V由647 nm激光激发,检测荧光发射光谱在647 nm处(APC通道),PI 通道发射光谱约在617 nm处。
2)在双变量流式细胞仪的散点图上,左下象限显示活细胞,为(FT™ 647A-Annexin V-/PI-);右下象限为早期凋亡细胞,为(FT™ 647A-Annexin V+/PI-);右上象限是坏死与晚期凋亡细胞 ,为(FT™ 647A-Annexin V+/PI +);左上象限显示裸核细胞,为(FT™ 647A-Annexin V-/PI+)。
(2)荧光显微镜检测
1)1000 rpm 离心5 min,收集细胞,用400 µL 1 ×Annexin V 结合缓冲液轻轻重悬细胞。将细胞移至96孔板中沉降片刻或进行细胞涂片后,置于荧光显微镜下观察。
2) FT™ 647A-Annexin V可用APC适用滤光片。PI可用Cy3或者Texas适用的滤光片。
4. 结果展示(示例)
(1)图 1 中左图为没有做任何处理的正常细胞,右图为诱导细胞凋亡后的细胞组。两图中均有十字门划分出各个象限,左上角:Annexin V-/PI+,机械损伤细胞;右上角:Annexin V+/PI+,晚期凋亡细胞或坏死;右下角:Annexin V+/PI-,早期凋亡细胞;左下角:Annexin V-/PI- ,正常细胞。
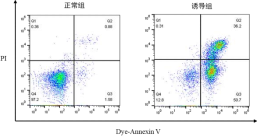
图 1 正常细胞和诱导凋亡细胞染色后流式细胞仪结果图
(2)图 2 是悬浮细胞Jurkat诱导凋亡后染色图。其中绿色为Annexin V染色细胞膜(以FITC为例),红色为染色细胞核(以PI为例)
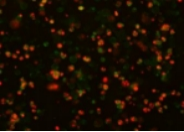
图 2 悬浮细胞Jurkat诱导凋亡染色后荧光显微镜结果图
6 注意事项
l使用前请将产品瞬时离心,再进行后续操作。
l为降低细胞凋亡进程,孵育过程可在冰上操作,但孵育时间至少延长至30 min。
l由于细胞凋亡是一个快速的过程,建议样品在染色后1 h之内进行分析。
l为了避免洗涤细胞时损失细胞,在吸液时可以用大的Tip头套上小的Tip头吸液。
l荧光染料均存在淬灭问题,实验操作时请尽量注意避光,以减缓荧光淬灭。
l本产品仅限于科研,不得用于临床诊断或治疗,不得用于食品和药品,不得存放于普通住宅内。
l为了您的安全和健康,请穿实验服并戴一次性手套操作。
(1)细胞本身状态不佳。建议重新铺细胞,获得状态良好的细胞。
(2)实验操作过程中带来的机械损伤,或者消化过度。建议控制好消化时间和轻柔处理细胞。
(3)染色时间过长,导致细胞长时间处于非生长环境导致凋亡。建议控制好染色时间,若样本过多,可分批进行。
(1)确认细胞有凋亡,确认染色Annexin V单染组是否有阳性。
(2)Annexin V是否有过冻融?冻融会明显影响效果。
(3)贴壁细胞用的胰酶消化液是否有EDTA,EDTA会影响Annexin V和PS的结合。
(4)确定药物诱导细胞凋亡,药物本身是否会破坏PS导致影响Annexin V与PS的结合。
(5)染料的最佳使用浓度由具体实验要求确定,可以适当调节染色的浓度。
Annexin V也可以用在植物和细菌中检测凋亡,具体实验步骤可参考相关文献。
对于贴壁细胞,消化是一个关键步骤。贴壁细胞诱导细胞凋亡时如有漂浮细胞,需收集漂浮细胞和贴壁细胞后合并染色。处理贴壁细胞时要小心操作,尽量避免人为的损伤细胞。胰酶消化时间过短,细胞需要用力吹打才能脱落,容易造成细胞膜的损伤,PI摄入过多;消化时间过长,细胞膜同样易造成损伤,甚至会影响细胞膜上磷脂酰丝氨酸与FITC-Annexin V的结合。消化时将胰酶铺满孔板底后,轻摇时胰酶与细胞充分接触,然后倒掉大部分胰酶,利用剩余的少量胰酶再消化一段时间,待细胞间空隙增大,瓶底呈花斑状即可终止。EDTA会影响Annexin V与PS的结合,因此在消化液中尽量不用EDTA。
贴壁细胞用胰蛋白酶消化后,建议在最佳培养条件和培养基中恢复约30 min后染色,避免假阳性。
(1)消化液中含有EDTA或消化时间过长引起的假阳性。Annexin V 和PS的结合需要Ca2+,而EDTA是Ca2+螯合剂,使用含有EDTA的胰酶会造成假阴性。其次消化时间不宜过长,吹打细胞要轻柔,因为胰酶的过度消化和机械损伤都会引起细胞膜的损伤,造成假阳性。细胞消化下来后,建议在培养箱中再孵育30 min,使细胞膜恢复完整性,避免假阳性,或者将细胞保存在含2% BSA的PBS中,防止进一步的损伤。
(2)如果样品来源于血液,必须去除血液中的血小板,因为血小板含有PS,能与Annexin V结合,干扰实验结果。建议:可以含有EDTA的缓冲液200 g 离心去除血小板,最后细胞多洗几遍,减小EDTA螯合钙离子产生的影响。
(3)神经细胞膜容易破坏外翻,导致假阳性,所以Annexin V/PI双染法流式检测细胞凋亡不适用于神经细胞。
(4)诱导时间过长。一般情况下诱导几个小时就可以出现早期凋亡,因此通常不需要处理大于48 h以上,诱导时间过长会使营养物质耗尽,导致细胞状态差,假阳性结果偏高。
合作咨询

扫描二维码
咨询合作
联系销售
7X24小时客服
0512-66523352

公众号

顶 部