1 产品基本信息
产品名称(中文):5-乙炔基-2’-脱氧尿苷(EdU)
产品名称(英文):EdU
产品编号:MX1536
产品规格:2 mg,10 mg,50 mg
2 产品介绍
EdU,即5-乙炔基-2’-脱氧尿嘧啶核苷(5-Ethynyl-2’-deoxyur idine)是一种胸腺嘧啶核苷类似物,能够在细胞增殖时期代替胸腺嘧啶(T)渗入正在复制的DNA分子中,通过基于EdU的乙炔基与FT™系列荧光染料标记的叠氮化物(Azide)通过一价铜离子催化下发生特异性反应,形成稳定的三唑环,该反应为点击化学反应(Click Reaction)。该反应可快速检测细胞DNA复制活性,准确检测细胞增殖能力。检测原理见图 1。
与BrdU检测方法相比,EdU检测方法用量小得多,十分之一的用量即可获得与BrdU检测试剂盒相同甚至更好的检测结果,而且小分子化学反应检测方法反应快、效率高,反应时间仅需几分钟,不需要DNA变性、蛋白酶处理、抗原抗体过夜孵育,能够更好地保护细胞形态,更简单、更灵敏、更快速、更准确。
EdU适用于各种动物活体注射,稳定性较好,对活体无明显副作用,可将目标组织制备为石蜡或冰冻组织切片后检测,也适用于体外培养的细胞增殖检测。本产品系列适用于小鼠、大鼠及其他动物模型的各种组织器官(血管除外)的细胞增殖检测。
本制品需与MX1543、MX1544、MX1545等EdU成像试剂盒配合使用。
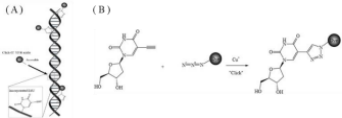
图1 检测原理图
产品特点:
l快速高效:点击化学反应,仅需几分钟可检测细胞DNA复制活性,准确检测细胞增殖能力;
l简便、精准:不需要DNA变性、蛋白酶处理、抗原抗体过夜孵育,能够更好地保护细胞形态;
l适用性广:适用范围广,适用于细胞和各种动物活体注射;
l使用方便:可搭配我司其它试剂使用,方便灵活。
适用范围:
适用于各种动物活体注射、适用于体外培养的细胞增殖检测
3 产品参数
CAS号:61135-33-9
分子量:252.2
溶解性:可溶于DMSO、PBS或生理盐水
分子结构图:
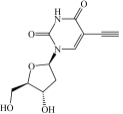
注:配置储液时,建议用DMSO溶解;该产品在DMSO中溶解性非常好。
4 储存与运输
储存条件:-20 ℃ 避光保存
运输条件:冰袋运输
5 使用方法(仅供参考)
自备材料
1. 耗材
(1)离心管 (2)免疫组化笔
2. 试剂
(1)无水DMSO (2)1 × PBS (pH 7.2~7.6) (3)固定剂(丙酮) (4)通透液
(0.5% Triton X-100 in PBS) (5)甲醇 (6)EdU 检测试剂(7)中性树脂
3. 仪器
荧光显微镜或流式细胞仪
操作步骤
1. 细胞裂解
(1)将转入报告基因的细胞中的培养基移除,加入PBS轻轻洗涤(贴壁细胞可直接进行此操作,悬浮细胞要离心收集细胞)。充分裂解按如下方案加入1×Lysis Buffer(用无菌水按4:1稀释A组分),然后将培养板 放在微型震荡器上室温震荡15 min ,充分裂解细胞得到裂解产物。
细胞培养板 | 96孔板 | 48孔板 | 24孔板 | 12孔板 | 6孔板 |
裂解液体积 | 30 µL | 60 µL | 120 µL | 250 µL | 500 µL |
注:裂解产物可室温保存6 h ,-70 ℃可长期存放(裂解产物不能多次反复冻融)。
(2)将充分裂解后的裂解产物,10000~15000 rpm离心3~5 min,收上清。
一、动物 EdU 注射造模及组织切片染色
(一)实验前须知
表 1 EdU 注射液配置参考
EdU | 0.1 mg | 1 mg | 2 mg | 10 mg | 50 mg | 500 mg |
PBS | 100 μL | 1 mL | 2 mL | 10 mL | 50 mL | 500 mL |
EdU 建议初始给药量为5 mg/kg ,稀释浓度为0.5~1 mg/mL。
注:1. 可采用PBS或生理盐水稀释。
2. 注射时可将EdU注射液进一步稀释,不会影响EdU的稳定性。
表 2 动物实验EdU标记时间及剂量参考
PubMed ID | Reference | Species | Method | Amount | Time | Tissue |
18272492 | Salic A,et al. PNAS. 2008 | Mice | 腹腔注射 | 100 μg | 96 h | Brain |
19554638 | Kaiser CL, et al.Laryngosco pe. 2009 | Chicken | 皮下注射 | 50 mg/kg | 72 h | Cochlear |
19494148 | Guo F, et al. J Neurosci.2009 | Mice | 腹腔注射 | 100 μg/g Body weight | 3 h | Brain |
19179611 | Veres.TZ, et al.Am J Pathol.2009 | Mice | 腹腔注射 | 50 mg/kg | 3 h/20 h | - |
20664699 | Wiley LA, et al. Mol Vis. 2010 | Mice | 腹腔注射 | 100~200 μg | 1 h | Eye |
20163731 | Schmidt EJ, et al. BMC Dev Biol. 2010 | Mice | 腹腔注射 | 200 μg | 30 min | embryo |
20064490 | Zeng C, et al. Brain Res.2010 | Mice | 腹腔注射 | 50 mg/kg | 4 h~30 d | Brain |
20038597 | Janas ML, et al. J Exp Med.2010 | Mice | 腹腔注射 | 100 μg | 4 h | Thymi |
21145612 | Sun H, et al. J Hepatol. 2011 | Mice | 腹腔注射 | 100 μg | 72 h | - |
注:另可参考BrdU实验的注射时间,EdU 浓度按本说明书建议起始浓度或另行摸索。
(二)EdU标记
1. 动物EdU注射(具体参数可参考表 2)
(1) 注射方式:依据客户实验而定,如腹腔注射、皮下注射、肌肉注射、尾静脉注射等方式,其中以腹腔注射为多。
(2) 标记时间:最佳标记时间依据具体实验目的而定,小肠等增殖快的组织宜采用短时间标记(< 12 h),大脑等增殖慢的组织器官可能需要长时间标记(如7天或更长时间)。
(3) 标记浓度:最佳标记浓度依据具体标记时间而定,5 mg/kg剂量适合大部分实验。
(4) 取样部位:依据客户实验目的而定,一次标记可以对多种组织和器官切片,由于小肠上皮组织增殖较快,可以作为标记参考。
注:建议任何实验均可取小肠组织检测细胞增殖情况,小肠上皮组织细胞增殖速度快,成年小鼠EdU注射6 h后即可检测到阳性信息,可用作实验阳性对照进行预实验。
(三)切片处理
1. 切片前处理:组织器官最好进行清洗 ,以去除血液、组织或器官中残留的EdU ,降低背景。
2. 切片厚度 :3~10 μm为宜,切片过厚可能影响切片背景。
3. 切片后处理:
(1) 石蜡切片处理:二甲苯脱蜡2次,每次10 min ,乙醇梯度(100%,95%,85%,75%)水合各1次,每次5 min,去离子水清洗1次,每次3 min。
(2) 冰冻切片处理:放置恢复到室温,加入适量丙酮,4 ℃固定10 min。
去除固定液,用PBS清洗3次,每次5 min。
注:建议根据实验选择合适的固定剂,若使用甲醛类固定剂进行固定,固定完成需先加入2 mg/mL甘氨酸清洗10 min,中和残留的固定液,再进行PBS清洗。
4. 将切片稍甩干,用组化笔在组织周围画圈(防止液体流走),稍干后在圈内加入适量通透液(0.5% Triton X-100 in PBS),覆盖样本即可,室温孵育15 min,去除通透液后用PBS清洗3次,每次5 min。
注:若在后续实验操作中发现组画笔画的圈被破坏,需及时补画。在组织固定和通透期间,配制Click-iT反应混合物(配制体系参考以下表 3中方案)。
二、EdU标记细胞
(一)EdU 储液准备
1 mg 的EdU加入396.5 μL DMSO配置成10 mM的储液。分装保存于-20 ℃。
(二)细胞标记
1. 取对数生长期细胞,以每孔4×103~1×105细胞(可根据细胞大小、生长速度以及实验处理的具体要求调整细胞数量和密度)接种于96孔板中,培养至正常生长阶段。
2. 根据实验需要进行各种药物处理。
3. 用细胞完全培养基按一定比例稀释10 mM EdU储液至合适浓度后加入细胞中,混匀;设置不加EdU处理的阴性对照组。
注:EdU的标记浓度需根据细胞类型加以调整,建议以10 μM的初始浓度进行摸索。
4. 细胞培养箱中孵育 2 h。
注:最佳孵育时间与细胞周期有关,大多数肿瘤细胞系均可采2 h的孵育时间。EdU 浓度与孵育时间相关,短时间孵育(<2 h)宜采用高浓度,如:10~50 μM;长时间孵育(>24 h)宜采用低浓度,如:1~10 μM。
(三)细胞固定及促渗
注:对于需要做细胞表面抗原标记的实验,可以考虑在完成EdU孵育后,以含3% BSA洗涤液洗涤细胞2次,在细胞固定促渗之前进行。
1. 孵育完成后,去除培养基。以1 × PBS清洗细胞两次,每次5 min,
以除去未掺入DNA的EdU残留,贴壁不牢的细胞可降低清洗强度。加入50 μL 4%多聚甲醛固定液,室温孵育20 min 后,去除固定液。
2. 每孔加入50 μL 2 mg/mL甘氨酸溶液,室温孵育5 min,中和残留的固定液。
3. 以每孔100 μL 3% BSA洗涤细胞2次。
4. 去除洗涤液,加入100 μL 0.5% Triton X-100,室温孵育10 min。
以下是使用本产品进行EdU标记后,选择MX1543、MX1544、MX1545等EdU成像试剂盒进行染色的操作方法。
三、EdU检测
注:本参考步骤每个切片使用100 µL的Click-iT反应混合物。用户可以根据自己的样本情况调整等比例减少所用的溶液体积。
(一)准备1×Click-iT EdU反应缓冲液(组分C):10×组分C试剂以去离子水稀释10倍即可。
(二)制备一份5×的Click-iT EdU反应添加物储液(组分E):加0.3 mL
去离子水至30 mg的E组分试管中(100 mg/mL),混匀至全部溶解。使用后,剩余储液存放在≤-20 ℃,可保存一年,溶液一旦呈现棕色,则说明有效成分降解不能再用。
注:不同规格的组分E均按照此比例加去离子水溶解为5×储液备用。
(三)准备1×Click-iT EdU缓冲液添加物:以去离子水稀释5×储液至1×,溶液应新鲜配制,当天用完。
(四)依据表3准备Click-iT反应混合物。表3要求添加的组分对于反应来说非常重要,否则反应无法有效进行。
表 3 Click-iT 反应混合物
反应组分 | 以 10 个样本数为例 |
1 ×Click-iT EdU 反应缓冲液(组分 B) | 860 µL |
CuSO4(组分 C) | 40 µL |
FT™ 488/555/594/647A Azide(组分 A) | 2 µL |
1 ×反应缓冲液添加物(步骤 3.3 所准备) | 100 µL |
总体积 | 1 mL |
(五)切片样本:去除步骤一/(三)/4的PBS,加入100 μL Click-iT反应混合物(表 3)至每个切片,使反应混合物均匀覆盖切片样本。
注:染色反应液的用量要依据切片大小而定,大多数器官切片均较小,只需将染色反应液滴在待观察区域即可。
(六)细胞样本:去除促渗剂,每孔100 μL的3% BSA洗涤液洗涤2次。每孔加入100 μL Click-iT工作液,均匀覆盖细胞。
(七)室温避光孵育30 min。
(八)切片样本:去除反应混合物,用3% BSA in PBS,清洗3次。
(九)细胞样本:除去Click-iT工作液,以100 μL 3% BSA 洗涤细胞2次后,去除洗涤液,加入100 μLPBS保持细胞湿润。
(十)切片样本:(加强)加入适量甲醇清洗2次,覆盖样本即可,每次5 min。去除甲醇,加入适量PBS清洗3次,每次5 min。
注:由于某些细胞类型对染料的吸附性较高,需采用加强方式洗脱以降低染料背景。
四、DNA复染
(一)以PBS稀释Hoechst 33342(组分F)储液1:2000至1×Hoechst33342溶液,终浓度为5 µg/mL。
(二)切片样本:去除步骤三,(八)的PBS,加入100 μL Hoechst 33342溶液至每个切片,覆盖样本即可,室温避光孵育20 min(建议根据实际染色情况对染色液浓度及染色时间上下摸索)。
(三)细胞样本:每孔加100 μL 1×Hoechst 33342溶液,室温避光孵育15~30 min。
(四)去除Hoechst 33342溶液,加入适量PBS清洗3次,每次5 min。
五、封片(组织切片)
(一)石蜡切片:去除PBS,将石蜡切片依次放入75%乙醇 2 min-85%乙醇2 min-95%乙醇2 min-无水乙醇 5 min-无水乙醇5 min,进行脱水,放入二甲苯中5 min ,进行透明,最后将切片从二甲苯取出,向样本上加入中性树胶进行封片。
(二)冰冻切片:去除 PBS ,向样本上加入中性树胶进行封片。
六、成像及分析
表 4 荧光发射光谱
Fluorophore | Excitation (nm) | Emission (nm) |
FT™488 Azide | 495 | 519 |
FT™555 Azide | 555 | 565 |
FT™647A Azide | 650 | 670 |
Hoechst 33342 ,bound to DNA | 350 | 461 |
注:建议封片完成后立即进行荧光显微镜拍照观察;如果条件限制,可将切片避光置于阴凉干燥处暂存,尽快观察拍照。
七、染色效果图(图 2)
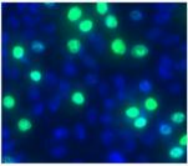
图 2 使用EdU对增殖的HeLa细胞进行细胞增殖分析用EdU孵育HeLa细胞2小时,然后固定、促渗并用FT™ Dye 叠氮化物和本司Hoechst 33342染色。结果是根据HeLa细胞的光散射特征通过荧光显微镜拍照得出。
6 注意事项
l使用前请将产品瞬时离心至管底,再进行后续实验。
l该产品对皮肤有不可逆损伤的可能性,请注意防护,避免吸入性风险。
l试剂保存:粉末在-20 ℃避光保存,1年有效;配置成溶液,-20 ℃避光保存,1个月有效,-80 ℃避光保存,6个月有效。
l荧光染料均存在淬灭问题,请尽量注意避光,以减缓荧光淬灭。
l请使用一次性手套,废液请妥善处理。
l本产品仅限于科研,不得用于临床诊断或治疗,不得用于食品或药品,不得存放于普通住宅内。
l为了您的安全和健康,请穿实验服并戴一次性手套操作。
(1)EdU处理时间太短导致没有阳性信号。体外细胞实验一般EdU处理时间宜为细胞周期长度的1/5~1/10,阳性率约为20~30%,体内实验需根据目的组织细胞的增殖速度进行调整,若细胞增殖速度慢,需要采用长时间的EdU处理时间。
(2)EdU处理时细胞已经长得过满而产生接触抑制等情况使得细胞没有发 生增殖。
(3)实验时如果未使用完全培养基配制EdU培养基而是使用无血清培养基配制EdU培养基,可能会使细胞同步化在G0/G1期而导致没有阳性信号或阳性信号很少。
(4)染色过程干片等因素导致未染上信号。
(5)对于阴性结果,可设置阳性对照(常见肿瘤细胞株如A549、HeLa EdU处理2小时或EdU处理6小时以上的小鼠小肠上皮组织)以确认染色过程无误,对于目的样品,可先使用较长的EdU处理时间以尽量先检测出阳性信号,再根据具体信号比例进行EdU处理时间的调整。
(1)染色后洗涤不充分,可尝试加强洗涤解决。
(2)染色过程中干片,导致染料粘附严重。
(3)多聚甲醛固定时间过长而未使用甘氨酸中和。
(4)没有阳性信号而曝光过度导致背景严重。
(1)FT™ Dye Azide染色信号与核染色信号(Hoechst33342或DAPI等核染信号)完全重合,或者与核重合的信号明显强于胞浆上的信号(染料附着等)。
(2)一般部分细胞上的信号呈现上述特征,而不是全部细胞。
(3)对于流式细胞术检测,则是通过设置阴性对照样品(不做EdU处理但同时进行FT™ Dye Azide 染色),高于阴性对照样品信号强度的为阳性信号。
合作咨询

扫描二维码
咨询合作
联系销售
7X24小时客服
0512-66523352

公众号

顶 部