1 产品基本信息
产品名称(中文):通用型 FT™ Click-iT EdU 细胞增殖检测试剂盒
产品名称(英文):Universal FT™ Click-iT EdU Cell Proliferation Kits
产品信息
货号 | 名称 | 规格 |
MX1543S | FT™ 488 Click-iT EdU通用款细胞增殖检测试剂盒(绿色荧光) | 2-20 T |
MX1543M | 10-100 T | |
MX1543L | 50-500 T | |
MX1544S | FT™ 555 Click-iT EdU通用款 细胞增殖检测试剂盒(橙红色荧光) | 2-20 T |
MX1544M | 10-100 T | |
MX1544L | 50-500 T | |
MX1545S | FT™ 647A Click-iT EdU通用款细胞增殖检测试剂盒(远红荧光) | 2-20 T |
MX1545M | 10-100 T | |
MX1545L | 50-500 T |
产品组分
组分 | 2~20T | 10~100T | 50~500T | 开封前保存温度 | 开封后保存温度 |
A. 10 mM EdU | 40 µL | 200 µL | 1 mL | -20℃避光保存 | -20℃ |
B. FT™488/555/647A Azide | 10 µL | 50 µL | 250 µL | -20℃ ,避光 | |
C. 10×Click-iT EdU 反应缓冲液 | 200 µL | 1 mL | 5 mL | 2~8℃ | |
D. CuSO4 | 100 µL | 500 µL | 2× 1.25 mL | 2~8℃ | |
E. Click-iT EdU缓冲液添加物 | 6 mg | 30 mg | 150 mg | -20℃ | |
F. Hoechst 33342 | 5 µL | 25 µL | 125 µL | 2~8℃ ,避光 |
规格:如果用于荧光显微镜检测,所能使用次数为上述各个规格的最大使用次数(针对96孔板培养的细胞),如MX1543S可检测20个孔的样品(不同容器的具体用量可参考表 2);如果用于流式检测,所能使用次数为上述各个规格的最小使用次数,如MX1543S可检测2个样品。
2 产品介绍
细胞增殖检测是评估细胞健康程度、遗传毒性及抗肿瘤药物效果的基础实验手段。检测细胞增殖最精确的方法是BrdU法,EdU法检测试剂盒是BrdU法的革命性突破。EdU(5-乙炔基-2’-脱氧尿苷)是一种嘧啶类似物,在DNA合成期整合入DNA双链,检测基于“点击”反应,一种由铜催化的叠氮化合物和炔烃作用发生共价反应形成共价键。点击法的EdU标记增殖快速有效、易于使用,只需多聚甲醛固定和Triton X-100促渗就可以使检测试剂进入细胞,只需少量的叠氮化染料即可非常有效地标记出整合的EdU;BrdU方法需要DNA变性(如酸变性、热变性或者用DNase消化)暴露出BrdU,从而方便BrdU抗体结合。本试剂盒包含EdU法检测所需要的所有组分,可以用于体外培养细胞的增殖检测。
产品特点:
l简单高效:无需抗原抗体反应,基于小分子化学反应的检测方法简单高效,反应仅需要几分钟;
l灵敏度高:无需抗体,检测染料仅BrdU抗体的1/500,很容易扩散,即便是单个增殖细胞也能准确检测;
l快速省时:无需过夜,省却了抗原抗体反应的复杂繁琐步骤,完成整个检测周期仅需5小时。
适用范围:
细胞增殖、分化、生长与发育、DNA损伤修复、病毒复制等方面的研究
3 产品参数
荧光光谱数据:
FT™488 Azide:495/519 nm;
FT™555 Azide:555/565 nm;
FT™647A Azide:650/670 nm;
Hoechst33342:350/461 nm (bound to DNA)
4 储存与运输
储存条件:-20 ℃ 避光保存
运输条件:冰袋运输
5 使用方法(仅供参考)
一、自备材料
1. 耗材
96/24/12/6 孔培养板或培养皿
2. 试剂
(1)10 mM PBS, pH7.2~7.6
(2)4%多聚甲醛固定液(in PBS)
(3)促渗试剂(0.5% Triton X-100 in PBS)
(4)2 mg/mL 甘氨酸溶液(in ddH2O)
(5)3% BSA in PBS, pH7.2~7.6
(6)1% BSA in PBS, pH7.2~7.6
(7)ddH2O
二、操作步骤
注 :开封后不同组分按指定温度保存。
1. 荧光显微镜检测方法
(1)细胞培养
取对数生长期细胞,以每孔4×103~1×105细胞(可根据细胞大小、生长速度以及实验处理的具体要求调整细胞数量和密度)接种于96孔板中,培养至正常生长阶段。
(2)药物处理
根据实验需要进行各种药物处理。
(3)EdU标记
1)用细胞完全培养基按一定比例稀释EdU溶液(组分A)至合适浓度后加入细胞中,混匀;设置不加EdU处理的阴性对照组。
注:EdU的标记浓度需根据细胞类型加以调整,建议以10 µM的初始浓度进行摸索。预实验中,建议设置EdU浓度梯度,可参考表 3和表 4。
2)细胞培养箱中孵育 2 h。
注:最佳孵育时间与细胞周期有关,大多数肿瘤细胞系均可采用2 h的孵育时间,可参考表 3 。EdU浓度与孵育时间相关,短时间孵育(< 2 h)宜采用高浓度,如:10~50 μM;长时间孵育(> 24 h)宜采用低浓度,如:1~10 μM;也可参考表 5。
(4)细胞固定及促渗
注:对于需要做细胞表面抗原标记的实验,可以考虑在完成EdU孵育后,以含3% BSA 洗涤液洗涤细胞2次,在细胞固定促渗之前进行。
1)孵育完成后,去除培养基。以1× PBS清洗细胞两次,每次5 min,以除去未掺入DNA的EdU残留,贴壁不牢的细胞可降低清洗强度。加入50 μL 4%多聚甲醛固定液,室温孵育20 min后,去除固定液。
2)每孔加入50 μL 2 mg/mL甘氨酸溶液,室温孵育5 min,中和残留的固定液。
3)以每孔100 μL 3% BSA洗涤细胞2次。
4)去除洗涤液,加入100 μL 0.5% Triton X-100,室温孵育 10 min。
(5)EdU检测
注 :本参考步骤每个样本使用100 μL的工作液,用户可以根据自己的样本情况调整用量。
1)配置1×Click-iT EdU反应缓冲液(组分C):用ddH2O将组分C稀释10倍。
2)配置5×Click-iT EdU缓冲液添加物(组分E):加300 μL的ddH2O至30 mg的E组分管中(终浓度100 mg/mL),混匀至全部溶解。请注意适当分装后,-20ºC保存。如果溶解后有白色物质析出,请上下颠倒多次,待全部溶解后使用。如果该溶液颜色变成棕色,说明该组分的有效成分已失效,请弃用。
注:不同规格的组分E均按照此比例加ddH2O溶解,制备成5×储液备用。
3)准备1×Click-iT EdU缓冲液添加物:用ddH2O稀释5×Click-iT EdU缓冲液添加物至1×,溶液应现配现用。
4)依据表 1 准备Click-iT工作液(工作液须在配制后15分钟内使用)。
表 1 Click-iT工作液
反应组分 | 以10个孔的样本数为例 |
1×Click-iT EdU反应缓冲液 | 855 µL |
CuSO4(组分D) | 40 µL |
FT™488/555/647A Azide(组分B) | 5 µL |
1×Click-iT EdU缓冲液添加物 | 100 µL |
总体积 | 1 mL |
5)去除促渗剂,每孔100 μL的3% BSA洗涤液洗涤2次。
6)每孔加入100 μL Click-iT工作液,均匀覆盖细胞。
7)室温避光孵育30 min。
8)除去Click-iT工作液,以100 μL 3% BSA洗涤细胞2次后,去除洗涤液,加入100 μL PBS保持细胞湿润。如其他无特别要求,即可进行拍照分析。
(6)DNA复染(可选)
1)用100 μL PBS洗涤细胞1次,去除洗涤液。
2)用PBS将Hoechst 33342(组分F)稀释2000倍。
3)每孔加100 μL 1×Hoechst 33342溶液,室温避光孵育15-30 min。
4)去除Hoechst 33342 溶液,用100 μL PBS洗涤细胞2次。
(7)成像及分析
建议染色完成后立即进行荧光显微镜拍照观察;如果条件限制,请于4 ℃条件下避光湿润保存3天之内完成拍照。
2. 流式细胞仪检测方法
(1)细胞培养
每孔1×105~3×106个细胞接种于6孔板中。
(2)药物处理
根据实验需要进行各种药物处理。
(3)EdU标记细胞
1)用细胞完全培养基按一定比例稀释EdU溶液(组分A)至合适浓度后加入细胞中,混匀;设置不加EdU处理的阴性对照组。
注:EdU的标记浓度需根据细胞类型加以调整,建议以10 µM的初始浓度进行摸索。预实验中,建议设置EdU浓度梯度,可参考表 3 和表 4。
2)细胞培养箱中孵育2 h。EdU孵育细胞的时间可以直接用作测定细胞DNA合成的指标,时间点选择以及孵育的时间取决于细胞生长速率。通过短暂的EdU孵育进行的脉冲式标记细胞可以用于研究细胞周期动力学。
注:最佳孵育时间与细胞周期有关,大多数肿瘤细胞系均可采用2 h的孵育时间,可参考表 3。EdU浓度与孵育时间相关,短时间孵育(< 2 h)宜采用高浓度,如:10~50 μM;长时间孵育(> 24 h)宜采用低浓度,如:1~10 μM;也可参考表 4。
(4)细胞固定及促渗
注:对于需要做细胞表面抗原标记的实验,可以考虑在完成EdU孵育后,以含 1%BSA洗涤细胞2次,在细胞固定促渗之前进行。
1)孵育完成后,收集细胞,每管加入1 mL PBS清洗细胞,1000 rpm 离心5 min,吸弃上清,以除去未掺入DNA的EdU残留。
2)每管加入1 mL 4%多聚甲醛固定液重悬细胞。
3)室温孵育20 min,1000 rpm离心5 min,吸弃上清。
4)每管加入1 mL 2 mg/mL甘氨酸孵育5 min,中和残留的固定液,1000 rpm离心5 min,吸弃上清,每管加入1 mL PBS清洗1次,1000 rpm离心5 min,吸弃上清。
5)每管加入1 mL 0.5% Triton X-100促渗液重悬细胞,室温孵育10 min。
(5)EdU检测
注:针对6孔板样本可参考每孔1 mL的工作液来进行,用户可以根据自己的样本情况调整用量。
1)配置1×Click-iT EdU反应缓冲液:用ddH2O将组分C稀释10倍。
2)配置5×Click-iT EdU缓冲液添加物(组分E):加 300 µL ddH2O至30 mg的组分E试管中(终浓度100 mg/mL),混匀至全部溶解。请注意适当分装后,-20ºC 保存。如果溶解后有白色物质析出,请上下颠倒多次,待全部溶解后使用。如果该溶液颜色变成棕色,说明该组分的有效成分已失效,请弃用。
注:不同规格的组分E均按照此比例加ddH2O溶解为5×储液备用。
3)准备1×Click-iT EdU缓冲液添加物:以ddH2O稀释5×Click-iT EdU缓冲液添加物储液至1×,溶液应现配现用。
4)依据表 2 准备Click-iT工作液(工作液须在配制后15分钟内使用)。
表 2 Click-iT 工作液
反应组分 | 单次反应所需加液体积 |
1×Click-iT EdU 反应缓冲液 | 875 μL |
CuSO4(组分 D) | 20 μL |
FT™488 / 555 / 647A Azide(组分 B) | 5 μL |
1×Click-iT EdU 缓冲液添加物 | 100 μL |
总体积 | 1 mL |
5)1000 rpm离5 min,吸弃上清,去除促渗剂,每管加入1mL的1% BSA洗涤液洗涤2次,1000 rpm离5 min,吸弃上清。
6)每管加入1 mL Click-iT工作液,混匀。
7)室温避光孵育30 min。
8)1000 rpm离心5 min,吸弃染色反应液,每管加入1% BSA洗涤细胞2次,1000 rpm离心5min,吸弃上清,用1 mL 1% BSA 再次重悬细胞(重悬细胞的溶液体积可根据细胞的数量加以调整),流式细胞仪检测。
注:如需进行其他标志物检测可参考步骤 4。
(6)DNA复染
1)用100 μL PBS洗涤细胞1次,去除洗涤液。
2)用PBS将Hoechst 33342(组分F)稀释2000倍。
3)每孔加100 μL 1×Hoechst 33342溶液,室温避光孵育15~30 min。
4)去除Hoechst 33342溶液,用100 μL PBS洗涤细胞2次。
(7)细胞内抗原标记(可选)
1)加入抗体工作液,混匀。
2)避光条件下,以合适的温度及时间孵育抗体。
(8)流式检测及分析
1)建议染色完成后立即进行流式检测;如果条件限制,请避光4 ℃湿润保存待测,但不应超过3天。
2)检测的细胞数量建议尽量能达到百万级,若细胞数量较少,检测的细胞数量可调整为十万级起始进行实验。对于细胞得率过少(刚到万级)的情况,可能不利于做流式图,对此可适当减少步骤(五)8中的清洗次数。
3. 结果展示
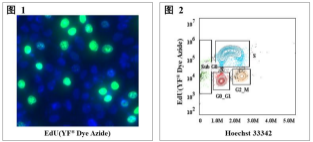
(1)图 1 使用EdU对增殖的HeLa细胞进行细胞增殖分析
用EdU孵育HeLa细胞2小时,然后固定、促渗并用FT™ Dye叠氮化物和本司Hoechst 33342染色。结果是根据HeLa细胞的光散射特征通过荧光显微镜拍照得出。
(2)图 2 使用EdU对增殖的HeLa细胞进行细胞周期分析
用EdU孵育HeLa细胞2小时,然后固定、促渗并用FT™ Dye叠氮化物和本司 Hoechst 33342染色。细胞周期的不同区段可通过DNA含量和EDU结合。结果是根据HeLa细胞的光散射特征通过流式细胞仪画门分析得出的。
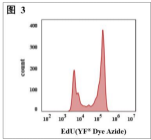
(3)图 3 使用EdU对增殖的HeLa细胞进行细胞增殖分析
用EdU孵育HeLa细胞2小时,然后固定、促渗并用FT™ Dye叠氮化物染色。结果是根据HeLa细胞的光散射特征通过流式细胞仪画门分析得出的。
附录
表 3 EdU 培养基及染色反应液的参考使用量
试剂 | 96孔板 | 48孔板 | 24孔板 | 12孔板 | 6孔板 | 5.5 cm小皿 |
EdU培养基 | 100 µL | 150 µL | 200 µL | 500 µL | 1 mL | 2 mL |
染色反应液 | 100 µL | 150 µL | 200 µL | 500 µL | 1 mL | 2 mL |
表 4 EdU 的参考孵育时间
细胞系 | 人胚胎细胞 | 酵母细胞 | 鼠成纤维细胞 | 人宫颈癌细胞 | 人胚肾细胞系 | 人神经细胞 |
细胞周期 | ~30 min | ~3 h | ~18 h | ~21 h | ~25 h | ~5 d |
孵育时间 | 5 min | 20 min | 2 h | 2 h | 2 h | 1 d |
注:1. EdU孵育时间取决于细胞周期,一般为细胞周期的1/10至1/5,但大多数细胞系均可采用2 h孵育时间。
2. 考虑到细胞培养基、温度、湿度、光线等其他因素的影响,细胞周期会有所变化。
表5 文献中EdU孵育浓度及时间
PubMed ID | Reference | Cell Line | Concentration | Time |
18272492 | Salic A,et al.PNAS.2008 | NIH3T3,Hela | 10 nM~10 µM | 1 h |
18521918 | Cappella P, et al. Cytometry A.2008 | HL-60,A2780, U2OS | 1~10 µM | 0.5 h |
18996411 | Chehehasa F, et al.Neurosci Methods.2009 | Neurospheres | 1~20 µM | 24 h |
19179371 | Limsirichaikul S, et al.Nucleic Acids Res.2009 | Primary fibroblasts | 10 µM | 1,2,4 h |
19253396 | Warren M, et al. Dev Dyn.2009 | Chick embryos | 10 µM~2 mM | 4 h |
19647746 | Yu Y, et al. J Immunol Methods.2009 | Spleen cells | 50 µM | 24 h |
19544417 | Momcilovic O, et al.Stem Cells.2009 | Human ES cells | 10 µM | 0.5 h |
20080700 | Cinquin O, et al. PNAS.2010 | emb-30 | 1 µM | 12 h |
20025889 | Han W, et al. Life Sci.2009 | VSMC | 50 µM | 2 h |
20659708 | Huang C, et al. J Genet Genomics.2010 | ESC | 50 µM | 2 h |
21310713 | Hua H, et al.Nucleic Acids Res.2011 | Fission yeaststrains | 10 µM | 3 h |
20824490 | Lv L, et al.Mol Cell Biochem.2011 | EJ cells | 50 µM | 4 h |
21248284 | Yang S, et al.Biol Reprod.2011 | GC cells | 50 µM | 2 h |
21227924 | Zhang YW, et al.Nucleic Acids Res.2011 | U2OS,HT29 | 30 µM | 1.5 h |
21829621 | Guo T, et al.PloS One. 2011 | HIT-T15 | 50 µM | 4 h |
21980430 | Zeng T, et al.PloS One. 2011 | MCF-10A | 25 µM | 2 h |
22012572 | Ding D, et al.Int Orthop.2011 | C3H10T1/2 | 10 µM | 24 h |
22000787 | Zeng W, et al.Biomaterials.2011 | EPC | 50 µM | 4 h |
21913215 | Xue Z, et al. J Cell Biochem.2011 | SGC7901 | 25 µM | 24 h |
22016038 | Peng F, et al.Lasera Med Sci.2011 | MSC | 50 µM | 2 h |
21878637 | Li D, et al. J Biol Chem.2011 | HCC | 50 µM | 2 h |
6 注意事项
l使用前请将产品瞬时离心至管底,再进行后续实验。
lEdU (10 mM)首次使用时建议根据实验需要分装,-20ºC 保存。
lClick-iT EdU缓冲液添加物溶液首次配制时建议根据实验需要适当分装,-20ºC 保存。如果溶解后有白色物质析出,请上下颠倒多次,待全部溶解后使用。如果该溶液颜色变成棕色,说明该组分的有效成分已失效,请弃用。
l可设置未进行EdU处理的细胞经FT™ Dye Azide染色作为阴性对照样品,用于确定合适的检测条件,此设置对干流式细胞术检测尤为重要,可以明确阴性信号的强度以划分阴性信号跟阳性信号的界限。
l本品不建议与TUNEL试剂盒同时检测。这是由于EdU的结构中有-OH存在,会影响TUNEL的反应过程。
l本产品属于铜离子催化的点击反应,可能会造成部分荧光蛋白或荧光染料淬灭,建议在点击反应完成后进行反应和检测,目前已确定受影响的染料有PE及PE tandems染料。
l铜离子会影响GFP、RFP、mCherry等荧光蛋白的荧光,因此本产品不适用于带GFP、RFP、mCherry等荧光的细胞检测。
l由于铜离子会破坏肌动蛋白结构,影响鬼笔环肽检测,所以Phalloidin (鬼笔环肽)与本产品不兼容,推荐使用Tubulin-Tracker Red (MX1404)进行细胞微管的检测。
l开封后的组分保存条件请按照说明书上进行保存。
l荧光染料均存在淬灭问题,请尽量注意避光,以减缓荧光淬灭。
l本产品仅限于科研,不得用于临床诊断或治疗,不得用于食品或药品,不得存放于普通住宅内。
l为了您的安全和健康,请穿实验服并戴一次性手套操作。
(1)EdU处理时间太短导致没有阳性信号。体外细胞实验一般EdU处理时间宜为细胞周期长度的1/5~1/10,阳性率约为20~30%,体内实验需根据目的组织细胞的增殖速度进行调整,若细胞增殖速度慢,需要采用长时间的EdU处理时间。
(2)EdU处理时细胞已经长得过满而产生接触抑制等情况使得细胞没有发 生增殖。
(3)实验时如果未使用完全培养基配制EdU培养基而是使用无血清培养基配制EdU培养基,可能会使细胞同步化在G0/G1期而导致没有阳性信号或阳性信号很少。
(4)染色过程干片等因素导致未染上信号。
(5)对于阴性结果,可设置阳性对照(常见肿瘤细胞株如A549、HeLa EdU处理2小时或EdU处理6小时以上的小鼠小肠上皮组织)以确认染色过程无误,对于目的样品,可先使用较长的EdU处理时间以尽量先检测出阳性信号,再根据具体信号比例进行EdU处理时间的调整。
(1)染色后洗涤不充分,可尝试加强洗涤解决。
(2)染色过程中干片,导致染料粘附严重。
(3)多聚甲醛固定时间过长而未使用甘氨酸中和。
(4)没有阳性信号而曝光过度导致背景严重。
(1)FT™ Dye Azide染色信号与核染色信号(Hoechst33342或DAPI等核染信号)完全重合,或者与核重合的信号明显强于胞浆上的信号(染料附着等)。
(2)一般部分细胞上的信号呈现上述特征,而不是全部细胞。
(3)对于流式细胞术检测,则是通过设置阴性对照样品(不做EdU处理但同时进行FT™ Dye Azide 染色),高于阴性对照样品信号强度的为阳性信号。
合作咨询

扫描二维码
咨询合作
联系销售
7X24小时客服
0512-66523352

公众号

顶 部